Michael Barth, M. Sc., Dr. Bastian Thaa, Dr. Marc Esser (veröffentlicht in Market Access & Health Policy 2021; 11(6): 24–26)
Evidenz im AMNOG
Medizinische Leitlinien im Market Access
Leitlinien bieten nicht nur Orientierungs- und Entscheidungshilfen im klinischen Alltag, auch in Nutzenbewertungsverfahren dienen sie als Grundlage zur Festlegung der zweckmäßigen Vergleichstherapie. Welche Bedeutung Leitlinien im Market Access haben, beleuchten wir im folgenden Artikel.
Einleitung und Definition
Leitlinien sind so etwas wie ein roter Faden in der Medizin. Sie bilden in vielerlei Hinsicht die Basis für Handlungsvorgaben in der Versorgung, egal ob es sich um Therapieempfehlungen für eine bestimmte Erkrankung handelt, um die Sicherung der Aktualität und Qualität von Disease-Management-Programmen oder aber auch die Festlegung der zweckmäßigen Vergleichstherapie (zVT) durch den G-BA für die Nutzenbewertung.
Leitlinien sind systematisch entwickelte Evidenzsynthesen. Grundlage für die Erstellung von Leitlinien sind beispielweise klinische Fragestellungen zu bestimmten Erkrankungen oder Behandlungsmethoden. Systematisch wird dazu das vorhandene medizinische Wissen erfasst und bewertet. An der Leitlinienerstellung sind neben klinischen Experten aus verschiedenen Fachgebieten die zuständigen Fachgesellschaften sowie Patienten oder Patientenvertreter beteiligt. Berücksichtigt werden dabei auch gegensätzliche Standpunkte, diese werden während der Leitlinienerstellung diskutiert und konsentiert. Sobald die systematische Bewertung der vorhandenen Informationen, die meist in Form von klinischen Studien vorliegen, abgeschlossen ist, werden auf Grundlage der Bewertungen entsprechend dem vorhandenen Evidenzniveau der berücksichtigten Daten Handlungsempfehlungen ausgesprochen. Dabei gibt es starke Empfehlungen (aufgrund der Bewertung von aussagekräftigen Metaanalysen oder Studien von höchstem Evidenzgrad, also randomisierten kontrollierten Studien) oder schwache Empfehlungen (wenn die zugrundliegende Datenbasis auf weniger hochwertigen Studien, etwa Beobachtungsstudien oder ausschließlich auf einer Expertenmeinung beruht). In der Evidenzhierarchie unterscheiden sich Leitlinien von systematischen Reviews insofern, dass sie neben der systematischen Bewertung der berücksichtigten Daten auch Handlungsempfehlungen geben. Diese Handlungsempfehlungen sollen es insbesondere Ärzten und Patienten erleichtern, Entscheidungen zu treffen. Vor allem die Transparenz der Empfehlung ist ein gewichtiges Kriterium und dient dazu, dass medizinische Entscheidungen und Behandlungen für alle Beteiligten nachvollziehbar sind. Für die individuelle Therapieentscheidung stellen Leitlinien eine Richtschnur dar, sie sind jedoch zumindest in Deutschland nicht bindend, da hier Therapiefreiheit besteht.
Evidenzbasierte Leitlinien setzen ein generelles systematisches Vorgehen in der gesamten Erstellung der Leitlinie voraus. Insgesamt entspricht ein Viertel der in Deutschland erstellten Leitlinien dem höchsten Evidenzlevel S3. Diese S3-Leitlinien sind evidenz- und konsensbasiert. Leitlinien mit einem niedrigen Evidenzniveau werden nicht systematisch erstellt, sondern basieren lediglich auf einer Konsensfindung aller beteiligten Personen. Ungefähr zwei Drittel der in Deutschland erstellten Leitlinien entsprechen dem nichtsystematischen Konsensniveau S1 und S2k (Abbildung 1).
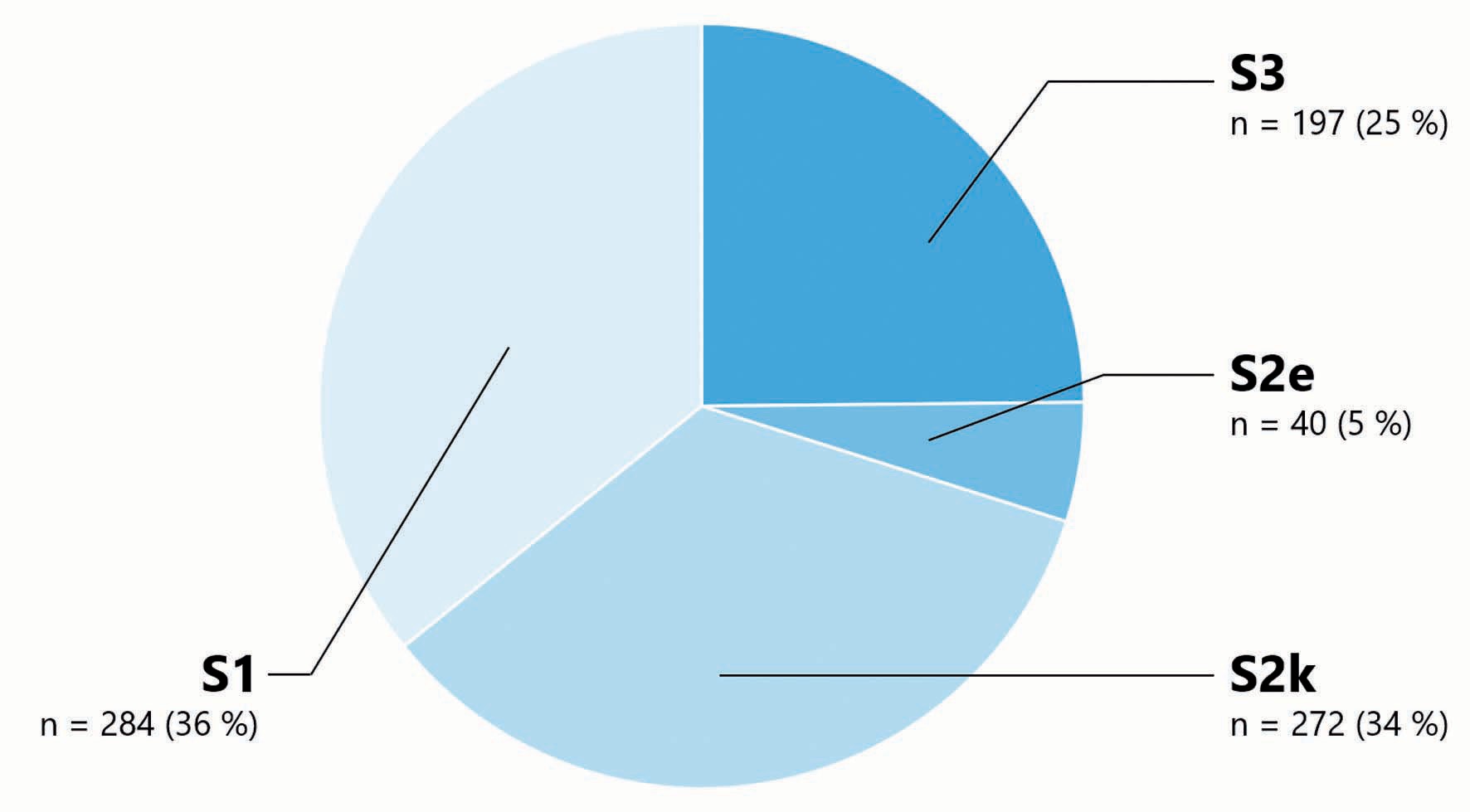
Abbildung 1: Evidenzniveau der aktuell verfügbaren Leitlinien (N=793) der AWMF (Stand 11.10.2021)
Leitlinien in Deutschland
Leitlinien haben sich als Grundlage zur Entscheidungsfindung im klinischen Alltag etabliert. Wissenschaftlich belegt ist dabei insbesondere der günstige Einfluss von Leitlinien auf die Prozess- und Ergebnisqualität im Gesundheitswesen.
Leitlinien werden in Deutschland vorrangig von der 1962 gegründeten Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V. (AWMF) entwickelt. Die AWMF ist der Dachverband von derzeit 180 medizinischen Fachgesellschaften und koordiniert die Arbeit der medizinischen Fachgesellschaften. Leitlinien werden aber auch unabhängig von der AWMF von einzelnen Fachgesellschaften oder Berufsverbänden erstellt und veröffentlicht. Alle von der AWMF veröffentlichten Leitlinien sind im Internet frei zugänglich (www.awmf.org/leitlinien). Die AWMF unterstützt hier die Zusammenarbeit der an der Leitlinie beteiligten Fachgesellschaften, gibt die Methodik vor und anschließend die Leitlinie heraus. Derzeit sind 793 aktuelle Leitlinien verfügbar und weitere 556 Leitlinien werden überarbeitet (Stand 11.10.2021). Leitlinien, die von der AWMF herausgegeben werden, sind nicht ausschließlich auf klinische Fragestellungen beschränkt, sondern beleuchten auch exotische Themen wie »Anforderungen der Hygiene beim Tätowieren« (Registernummer 029-024). Leitlinien, die in Deutschland unter der Federführung der AWMF entwickelt werden, gelten gemeinhin als transparent.
Die Erstellung einer Leitlinie ist insgesamt eine aufwändige Gemeinschaftsarbeit, bei der mitunter mehrere Fachgesellschaften mit unterschiedlichen Sichtweisen und Interessen zu koordinieren sind. So waren an der derzeit aktuellen Nationalen Versorgungs-Leitlinie (NVL) Typ-2-Diabetes (Registernummer nvl-001) neben 3 Herausgebern (AWMF, Bundesärztekammer und Kassenärztliche Bundesvereinigung) 34 Fachgesellschaften beteiligt. Auch im Ausland werden Leitlinien auf ähnlichen evidenz- und konsensbasierten Grundlagen erarbeitet. Diese bilden jedoch nicht notwendigerweise den deutschen Versorgungskontext ab und sind daher für den Market Access in Deutschland meistens von nachrangiger Bedeutung.
Im Market Access spielen Leitlinien eine bedeutende Rolle
Im Market Access sind Leitlinien in Deutschland insbesondere im Nutzenbewertungsverfahren von Bedeutung. Für Arzneimittel mit neuen Wirkstoffen gibt es in Deutschland nach Zulassung einen freien Marktzugang und eine Erstattung mit der Markteinführung. Die Arzneimittel durchlaufen die frühe Nutzenbewertung, dabei wird der Zusatznutzen des neuen Medikamentes im Vergleich zur zVT bewertet. Die zVT wird vom G-BA festgelegt und bildet den aktuellen Therapiestandard in Deutschland ab. Die Höhe des Zusatznutzens im Vergleich zur zVT entscheidet letztendlich den Preis des Arzneimittels. Daher ist die zVT ein wesentlicher Faktor für die Nutzenbewertung.
Die zVT ist eine Therapie, die bereits Leistung der Gesetzlichen Krankenversicherung ist und dem allgemein anerkannten Stand der medizinischen Erkenntnisse entspricht (§ 2 Abs.1 Satz 3 SGB V). Der G-BA legt aufgrund einer systematischen Erfassung aller in Betracht kommenden Arzneimittel oder Behandlungsmethoden in der entsprechenden Indikation die zVT fest. Hierzu wird die verfügbare Literatur systematisch erfasst und hierarchisiert. Das erfolgt entsprechend dem allgemeinen Standard der Evidenzbasierten Medizin (EbM) (vgl. § 6 Abs.3 VerfO G-BA). In der systematischen Recherche des G-BA werden insbesondere vorangegangene G-BA-Beschlüsse, IQWiG-Berichte, Cochrane-Reviews, systematische Reviews, Leitlinien und weitere relevante ergänzende Dokumente herangezogen. Hier spielen also die Leitlinien eine wichtige Rolle, denn aktuelle hochwertige Leitlinien bilden den höchsten Evidenzlevel ab, da sie neben einer systematischen Bewertung auch konsentierte Therapie-Empfehlungen enthalten. Leitlinien, die den deutschen Versorgungsalltag widerspiegeln, werden wiederum bevorzugt berücksichtigt. Leitlinien mit einem höheren Evidenzlevel (S2e oder S3) werden insgesamt höher gewichtet als Leitlinien mit einem niedrigen Evidenzlevel (S1 oder S2k).
Der G-BA hat strenge Anforderungen an die Evidenz
In der zVT-Festlegung sind Leitlinien häufig dann Streitpunkte, wenn dem G-BA die Evidenzgenerierung der Leitlinie nicht ausreicht. Der G-BA hat hierfür Mindestanforderungen: Leitlinien müssen entsprechend den Prinzipien der EbM erstellt werden, also eine dokumentierte systematische Literaturrecherche enthalten und eine nachvollziehbare Verknüpfung zwischen Empfehlung und der zugrundeliegenden Evidenz besitzen, das entspricht den Leitlinien der Evidenzstufen S3 und S2e. So werden vom G-BA regelmäßig Leitlinien der Deutschen Gesellschaft für Hämatologie und Medizinische Onkologie (DGHO), der European Society for Medical Oncology (ESMO) oder des National Comprehensive Cancer Network (NCCN) nicht berücksichtigt, da dem G-BA die zugrundeliegende Methodik nicht genügt. Die Fachberatung Medizin des G-BA, die die Recherche zur zVT durchführt, schreibt in ihren Einschätzungen zur »Recherche und Synopse der Evidenz zur Bestimmung der zweckmäßigen Vergleichstherapie nach § 35a SGB V« bei methodisch nicht ausreichenden Leitlinien den entsprechenden Hinweis in die Evidenzsynopse zur zVT (»Die Leitlinie erfüllt nicht ausreichend die methodischen Anforderungen. Aufgrund limitierter/fehlender höherwertiger Evidenz wird die Leitlinie jedoch ergänzend dargestellt.«).
Das ist einerseits nachvollziehbar, legt man hier die strengen Kriterien der EbM an. Jedoch geht hier die strenge Methodik zu Lasten der Aktualität. Die genannten Leitlinien der DGHO, der ESMO und des NCCN genügen zwar nicht den formalen Anforderungen des G-BA, jedoch werden diese Leitlinien sehr häufig aktualisiert, teilweise mehrmals im Jahr, um neue relevante und wichtige Studienergebnisse zu berücksichtigen. Damit sind diese Leitlinien zwar sehr aktuell, andererseits leidet die Methodik. Im Vergleich dazu können S3-Leitlinien aufgrund des Umfangs, der Methodik, der vielen beteiligten Fachgesellschaften und des Erstellungs- und Konsensprozesses nicht vergleichbar schnell aktualisiert werden. Das ist auch ein bekannter Nachteil von S3-Leitlinien, diese sind bei Veröffentlichung aufgrund der Einführung neuer Therapien teilweise bereits nicht mehr aktuell.
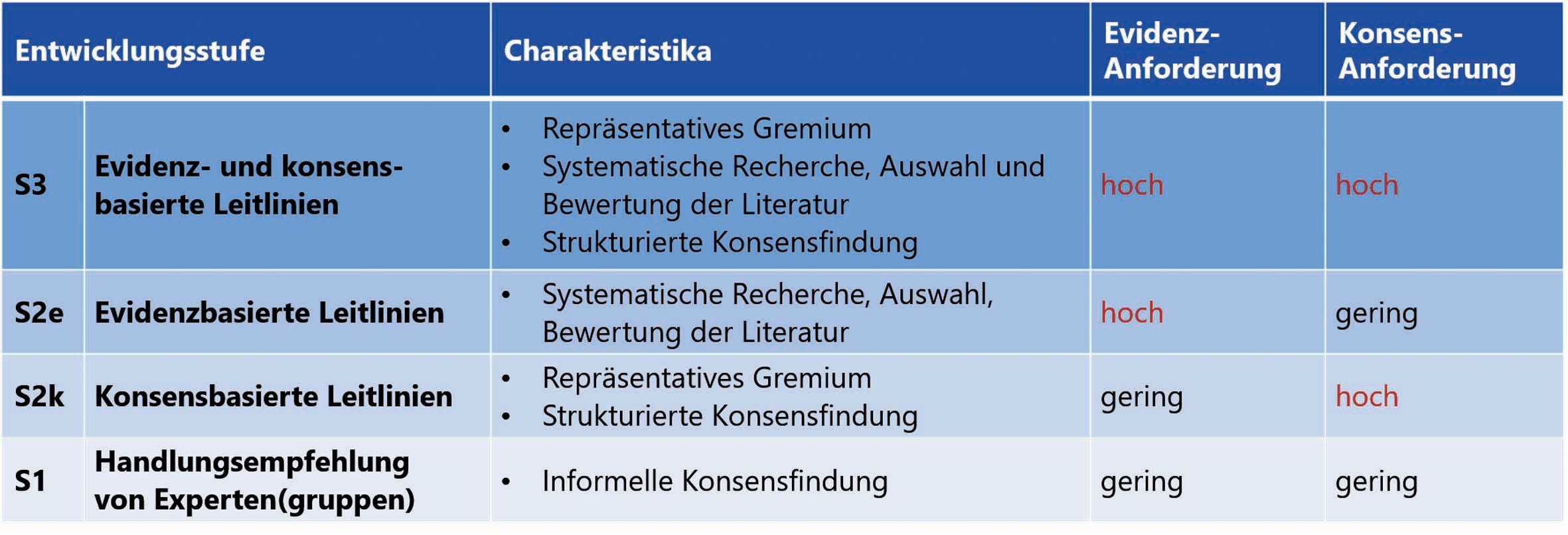
Tabelle 1: Klassifikation der Leitliniensystematik in Deutschland. Quelle: https://www.leitlinien.de/hintergrund/leitliniengrundlagen
Der G-BA bewertet rein formal
Die Einschätzungen der Fachberatung Medizin des G-BA bilden die Grundlage für die Bestimmung der zVT in den Beratungsverfahren und der darauf folgenden Nutzenbewertung. Die Nichtberücksichtigung der betroffenen Leitlinien führt dazu, dass die in diesen Leitlinien empfohlenen Therapien nicht als zVT herangezogen werden. Für den pharmazeutischen Unternehmer (pU) ist das nicht immer eindeutig und nachvollziehbar, insbesondere dann, wenn sich der pU nicht ausreichend mit dem deutschen Procedere der Nutzenbewertung auskennt. Leitlinien bilden zwar nur einen Teil der berücksichtigten Gesamtevidenz ab, jedoch sind sie aufgrund der darin enthaltenen konsentierten Empfehlungen zu Wirkstoffen oder Behandlungen von entscheidender Bedeutung. Sind jedoch die Empfehlungen für den G-BA nicht ausreichend transparent, werden die entsprechenden Leitlinien nicht berücksichtigt. Die Chance, dass der G-BA die »gewünschte« Vergleichstherapie als zVT festsetzt, ist deutlich höher, wenn die Vergleichstherapie in den hochwertigen Leitlinien vorrangig empfohlen wird. Deswegen sollten die Studien, die der Nutzenbewertung zugrunde gelegt werden, möglichst den Therapiestandard abbilden, der aus den hochwertigen, für Deutschland relevanten Leitlinien hervorgeht. Wesentlich ungünstiger ist es, wenn die Vergleichstherapie in den Studien nicht die zVT abdeckt. Dann muss der pU versuchen, über einen geeigneten indirekten Vergleich den Nachweis eines Zusatznutzens zu erbringen, falls er keinen »dramatischen Effekt« für sein Arzneimittel beanspruchen kann.
Globale Pharmaunternehmen haben mit der Festlegung der zVT durch den G-BA und den daraus resultierenden Anforderungen häufig ein Problem. Klinische Studien werden immer noch vor allem mit Blick auf eine zeiteffiziente Zulassung geplant und weniger auf HTA-Erfordernisse hin optimiert. Bereits im Vergleich der Voraussetzungen für eine europäische Zulassung und die frühe Nutzenbewertung in Deutschland gibt es erhebliche Unterschiede. Auch die FDA hat andere Prioritäten als die deutsche Nutzenbewertung und zielt natürlich mit ihrer Beratung auf den US-amerikanischen Markt ab. Daher erfüllt eine globale Studie nicht unbedingt die Anforderungen der deutschen Nutzenbewertung. Und selbst dann, wenn die in der Studie verwendete Vergleichstherapie den Therapieempfehlungen einer anerkannten und für Deutschland relevanten Leitlinie entspricht, kann die nicht ausreichende Methodik dieser Leitlinie dazu führen, dass die Vergleichstherapie nicht als zVT festgesetzt wird. Daher ist es unbedingt nötig, schon bei der Studienplanung die Leitliniensituation für Deutschland im Blick zu haben und möglichst die Empfehlungen der Leitlinien mit höchstem Evidenzgrad in den Studien zu berücksichtigen.
Leitlinien im Market Access proaktiv begleiten und nutzen
Pharmaunternehmen haben wenig Spielraum, ihre Positionen in Leitlinien einzubringen. Dennoch sollten sie natürlich proaktiv Studienergebnisse gegenüber Fachgesellschaften und klinischen Experten kommunizieren, um sicherzustellen, dass diese auch wahrgenommen werden. Dabei können wir Sie gerne unterstützen. Auch die Recherche der jeweils passenden Leitlinie für die Nutzenargumentation kann eine Herausforderung sein. co.value verwendet hierfür unter anderem das Tool UpToDate®. So erreichen wir, dass unsere Kunden das komplexe Thema Leitlinien optimal im Market Access nutzen können.
Fazit
Leitlinien sind ein wichtiger Baustein in der medizinischen Versorgung und stellen eine transparente Hilfe zur Entscheidungsfindung für Ärzte und Patienten in einer bestimmten Indikation dar. Unabhängig davon muss jede einzelne Therapieentscheidung individuell getroffen werden. Ein Großteil aller veröffentlichten Leitlinien unterliegt jedoch starken methodischen Einschränkungen und genügt nicht ausreichend den Kriterien der EbM. Hochwertige Leitlinien auf Grundlage der EbM (insbesondere S3-Leitlinien) können Aussagen bezüglich der zVT in einer bestimmten Indikation unterfüttern und sind somit von großer Relevanz in der Nutzenbewertung.